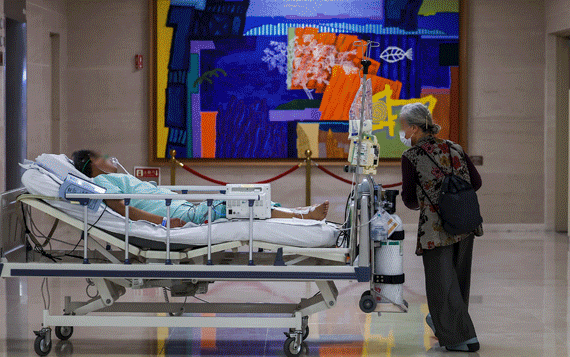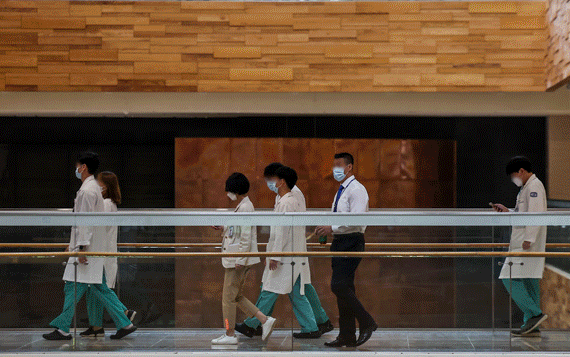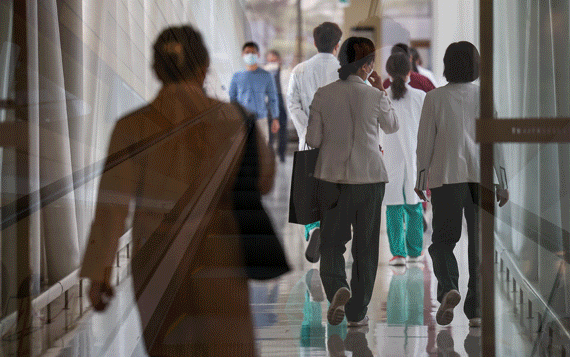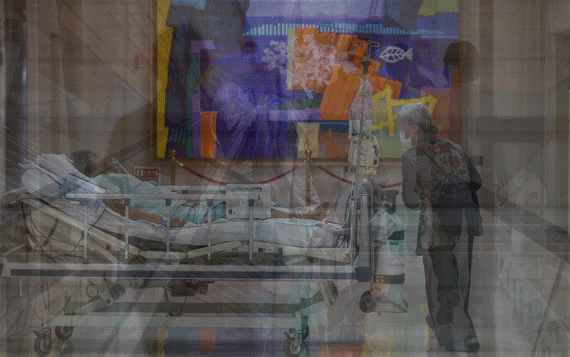미 FDA, 20년만의 알츠하이머 치료제 7일 승인여부 결정
증상 완화를 넘어 병 진행을 막고자하는 첫 치료제…반대도 많아
![[AP/뉴시스] 2018년 8월 자료사진으로 미국 애리조나주 피닉스 병원에서 한 의사가 PET 뇌 스캔을 보고 있다](http://image.newsis.com/2020/07/30/NISI20200730_0016522797_web.jpg?rnd=20210606214410)
[AP/뉴시스] 2018년 8월 자료사진으로 미국 애리조나주 피닉스 병원에서 한 의사가 PET 뇌 스캔을 보고 있다
'아두카누맙(aducanumab)'으로 불리는 이 약제는 이 노인성 치매 초기에 기억 및 사고의 문제 발생과 진행을 지연시키는 것이 목표이다. 만약 승인되면 2003년 이후 첫 새 알츠하이머 병 약이면서 단순히 증상을 완화하지 않고 병의 진행을 막고자 하는 첫 치료제로 시장에 나온다고 신문은 말했다.
시장 분석가들은 승인과 동시에 이 약은 수 년 안에 블록버스터(초대형 히트작)가 돼 해마다 환 자 한 명에게 수 만 달러를 부담시키면서 제조사 바이오젠은 횡재할 것으로 내다보고 있다.
치료제에 목말라온 환자 단체들은 보건 당국의 승인을 촉구하고 있다. 그러나 이 약은 몇몇 유명한 알츠하이머 병 전문가들 및 FDA 내 독립자문위원회의 반대에 직면해 있어 승인 기대가 물거품으로 끝날 수 있다고 타임스는 말했다.
지난해 11월 자문위는 압도적 투표를 통해 이 약제 데이터가 인지력 쇠퇴를 늦춘다는 주장을 설득력있게 제시하지 못하고 있다고 지적했다. 이 중 3명의 위원은 후에 증거 비판 사항을 조목조목 제시했으며 다른 과학자들 및 한 독립적 싱크탱크는 아두카누맙이 안전성 위험을 감당해도 좋을 만큼 큰 혜택이 있다고 할 수 없다고 말했다.
일부 의학 전문가들은 이 약이 승인되면 장래 약제들의 승인 기준이 대폭 낮아지고 말 것이라는 우려까지 제기했다.
현재 미국에서 약 600만 명, 전 세계적으로 약 3000만 명이 알츠하이머 병을 앓고 있으며 이 수는 2050년 안에 배로 늘어날 전망이다.
또 현재 미국에서 5개의 약제가 알츠하이머 병 여러 단계 환자에게 수 개월 동안 인지력 쇠퇴를 지연시킬 수 있는 것으로 승인되었다. 아두카누맙은 미국서 약한 알츠하이머 병 관련 손상을 보이고 있는 200만 명을 주 타깃으로 하는 월 단위 정맥주입제다.
제약사 바이오젠은 타임스의 기사에 대한 논평을 거절했지만 인지력 혜택의 증거가 확실하다고 말해왔다. 바이오젠 상담 전력이 있는 여러 알츠하이머 병 전문가들이 최근에 아두카누맙이 "유의미한 효과의 기준을 적절한 안전성과 함께 성취했다"고 썼다고 신문은 전했다.
◎공감언론 뉴시스 [email protected]
Copyright © NEWSIS.COM, 무단 전재 및 재배포 금지